QUÍMICA ANALÍTICA II
Em um laboratório, 50,0 mL de solução aquosa de NH3 a 0,1 mol L-1 , foram titulados com 5,0 mL de solução de HCl a 0,1 mol L-1. Qual das alternativas contém o valor correto do pH dessa mistura.
Dados: NH3 kb = 1,8 x 10-5
pH = 9,70
pH = 3,79
pH = 7,00
pH = 5,83
pH = 10,21
Em um erlenmeyer foram colocados 20,0 cm3 de solução aquosa de ácido sulfúrico 0,1M, mais gotas de fenolftaleína (indicador, que é incolor em meio ácido e róseo em meio alcalino). Em seguida, com auxílio de uma bureta, foi transferida para o erlenmeyer solução aquosa de hidróxido de sódio 0,1M gota a gota, agitando constantemente para homogeneização. A solução do erlenmeyer terá a cor rósea persistente quando o volume de solução de hidróxido de sódio transferido for de:
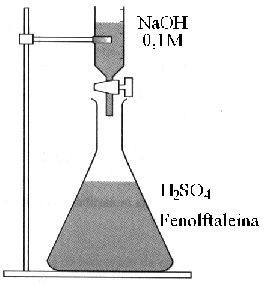
40,1 cm3
10,2 cm3
25,5 cm3
20,1 cm3
30,0 cm3
Quantos mililitros de uma solução 0,050 M de EDTA são necessários para reagir com 50 mL de uma solução 0,0100 M de Ca2+.
60 mL
20 mL
50 mL
10 mL
40 mL
Durante uma titulação de base forte e ácido forte, foram usados 25 mL de NaOH a 0,2 mol/L para titular 50 mL de solução de H2SO4. Qual é a concentração em mol/L do ácido nessa solução:
0,05 mol L-1
0,02 mol L-1
0,025 mol L-1
0,01 mol L-1
0,1 mol L-1
Um estudante transferiu 0,200 g de uma amostra contendo Fe3+ para um recipiente adequado e, após devido tratamento, todo íon foi reduzido à Fe2+. Em seguida, a solução foi titulada por 20 mL de K2Cr2O7 0,0167 mol/L. Determine a % de Fe (MM = 56 g/mol) na amostra.
Cr2O7 2- + 6 Fe2+ + 14 H + ----> 2 Cr3+ + 6 Fe3+ + 7 H2O
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
pH = 9,70
pH = 3,79
pH = 7,00
pH = 5,83
pH = 10,21
Em um erlenmeyer foram colocados 20,0 cm3 de solução aquosa de ácido sulfúrico 0,1M, mais gotas de fenolftaleína (indicador, que é incolor em meio ácido e róseo em meio alcalino). Em seguida, com auxílio de uma bureta, foi transferida para o erlenmeyer solução aquosa de hidróxido de sódio 0,1M gota a gota, agitando constantemente para homogeneização. A solução do erlenmeyer terá a cor rósea persistente quando o volume de solução de hidróxido de sódio transferido for de:

40,1 cm3
10,2 cm3
25,5 cm3
20,1 cm3
30,0 cm3
Quantos mililitros de uma solução 0,050 M de EDTA são necessários para reagir com 50 mL de uma solução 0,0100 M de Ca2+.
60 mL
20 mL
50 mL
10 mL
40 mL
Durante uma titulação de base forte e ácido forte, foram usados 25 mL de NaOH a 0,2 mol/L para titular 50 mL de solução de H2SO4. Qual é a concentração em mol/L do ácido nessa solução:
0,05 mol L-1
0,02 mol L-1
0,025 mol L-1
0,01 mol L-1
0,1 mol L-1
Um estudante transferiu 0,200 g de uma amostra contendo Fe3+ para um recipiente adequado e, após devido tratamento, todo íon foi reduzido à Fe2+. Em seguida, a solução foi titulada por 20 mL de K2Cr2O7 0,0167 mol/L. Determine a % de Fe (MM = 56 g/mol) na amostra.
Cr2O7 2- + 6 Fe2+ + 14 H + ----> 2 Cr3+ + 6 Fe3+ + 7 H2O
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?

40,1 cm3
10,2 cm3
25,5 cm3
20,1 cm3
30,0 cm3
Quantos mililitros de uma solução 0,050 M de EDTA são necessários para reagir com 50 mL de uma solução 0,0100 M de Ca2+.
60 mL
20 mL
50 mL
10 mL
40 mL
Durante uma titulação de base forte e ácido forte, foram usados 25 mL de NaOH a 0,2 mol/L para titular 50 mL de solução de H2SO4. Qual é a concentração em mol/L do ácido nessa solução:
0,05 mol L-1
0,02 mol L-1
0,025 mol L-1
0,01 mol L-1
0,1 mol L-1
Um estudante transferiu 0,200 g de uma amostra contendo Fe3+ para um recipiente adequado e, após devido tratamento, todo íon foi reduzido à Fe2+. Em seguida, a solução foi titulada por 20 mL de K2Cr2O7 0,0167 mol/L. Determine a % de Fe (MM = 56 g/mol) na amostra.
Cr2O7 2- + 6 Fe2+ + 14 H + ----> 2 Cr3+ + 6 Fe3+ + 7 H2O
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
60 mL
20 mL
50 mL
10 mL
40 mL
Durante uma titulação de base forte e ácido forte, foram usados 25 mL de NaOH a 0,2 mol/L para titular 50 mL de solução de H2SO4. Qual é a concentração em mol/L do ácido nessa solução:
0,05 mol L-1
0,02 mol L-1
0,025 mol L-1
0,01 mol L-1
0,1 mol L-1
Um estudante transferiu 0,200 g de uma amostra contendo Fe3+ para um recipiente adequado e, após devido tratamento, todo íon foi reduzido à Fe2+. Em seguida, a solução foi titulada por 20 mL de K2Cr2O7 0,0167 mol/L. Determine a % de Fe (MM = 56 g/mol) na amostra.
Cr2O7 2- + 6 Fe2+ + 14 H + ----> 2 Cr3+ + 6 Fe3+ + 7 H2O
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
0,05 mol L-1
0,02 mol L-1
0,025 mol L-1
0,01 mol L-1
0,1 mol L-1
Um estudante transferiu 0,200 g de uma amostra contendo Fe3+ para um recipiente adequado e, após devido tratamento, todo íon foi reduzido à Fe2+. Em seguida, a solução foi titulada por 20 mL de K2Cr2O7 0,0167 mol/L. Determine a % de Fe (MM = 56 g/mol) na amostra.
Cr2O7 2- + 6 Fe2+ + 14 H + ----> 2 Cr3+ + 6 Fe3+ + 7 H2O
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
78,2% de Fe
42,7% de Fe
92,5% de Fe
56,1% de Fe
30,2% de Fe
Os alvejantes são comumente constituídos de agentes oxidantes, que retiram elétrons dos materiais coloridos, transformando-os em outras substâncias incolores, normalmente solúveis em água. Por exemplo, na limpeza de uma peça de roupa branca manchada de iodo (cor púrpura), pode-se aplicar uma solução aquosa de tiossulfato de sódio (Na2S2O3), que originará produtos incolores e solúveis em água, conforme indicado abaixo.
I2 (s) + 2Na2S2O3 (aq) à 2NaI (aq) + Na2S4O6 (aq)
O valor aproximado do volume mínimo, em mL, de uma solução 1,0 M de Na2S2O3, necessário para reagir completamente com 2,54 g de I2, será:
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
10
40
20
0,01
0,04
Feita uma titulação de 100,0 mL de uma solução 0,100 mol/L de Fe2+ com uma solução 0,0200 mol/L de KMnO4 em meio de ácido sulfúrico 0,5 mol/L. Considere a temperatura da titulação como sendo 25 °C. Determine a energia gerada (E) no ponto de equivalência.
MnO4- (aq) + 8 H+ (aq) + 5 e - Mn2+ (aq) + 4 H2O(l) E◦= 1,51 V
Fe3+ (aq) + e - Fe2+ (aq) E◦= 0,77 V
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
1,39 V
0,74 V
3,19 V
2,33 V
0,89 V
O dicromato de potássio (K2Cr2O7) pode ser utilizado para a determinação do teor de carbono orgânico do solo. A reação não balanceada está representada a seguir:
Cr2O72– + CH2O + H+ → Cr3+ + CO2 + H2O
Sobre esse processo foram feitas algumas afirmações:
I. O ânion dicromato é o agente oxidante, possibilitando a oxidação da matéria orgânica a dióxido de carbono.
II. É necessário 0,5 L de solução aquosa de dicromato de concentração 0,20 mol.L–1 para oxidar completamente, em meio ácido, 4,50 g de matéria orgânica presente no solo.
III. Na reação para cada mol de dicromato (Cr2O72–) que reage são consumidos 8 mol de cátions H+.
Sobre essas sentenças pode-se afirmar que
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
apenas a II e a III são verdadeiras.
todas são verdadeiras.
apenas a I é verdadeira.
apenas a I e a III são verdadeiras.
apenas a II é verdadeira.
Sabendo-se que a solubilidade do Fe(OH)3 a 20oC é igual a 4,0×10-12mol/L o seu produto de solubilidade nessa temperatura será:
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22
A 50 mL de uma solução aquosa 0,20 mol/L em BaCl2 acrescentou-se 150 mL de uma solução aquosa 0,10 mol/L em NaSO4. Supondo que a precipitação de BaSO4 tenha sido completa, quais serão as concentrações, em mol/L, de Cl1 e SO42, respectivamente, na mistura final?
8,70 . 10-13
6,91 . 10-45
5,76 . 10-34
4,80 . 10-23
1,66 . 10-22